Abteilung Medizinprodukte
Das Abkommen über die Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (Abkommenstext) gibt für die Tätigkeit der ZLG das Ziel vor, den in Deutschland erreichten Stand an Qualität und Sicherheit von Medizinprodukten im Rahmen und auf der Grundlage der
- Richtlinie 90/385/EWG
des Rates vom 20. Juni 1990 über aktive implantierbare medizinische Geräte, - Richtlinie 93/42/EWG
des Rates vom 14. Juni 1993 über Medizinprodukte, und der - Richtlinie 98/79/EG
des Europäischen Parlamentes und des Rates vom 27. Oktober 1998 über In-vitro-Diagnostika
zu halten und zu verbessern. Diese Europäischen Richtlinien wurden durch das Medizinproduktegesetz (MPG) und die hierzu erlassenen Rechtsverordnungen in deutsches Recht umgesetzt.
Die Umsetzung des MPG ist Aufgabe der Länder. So vollzieht die ZLG im Bereich Medizinprodukte die Aufgaben der 16 Länder hinsichtlich der Anerkennung und Benennung. Darunter sind insbesondere die Benennung, Anerkennung und Überwachung von Zertifizierungsstellen und Prüflaboratorien in den Bereichen der Medizinprodukte und In-vitro-Diagnostika zu verstehen.
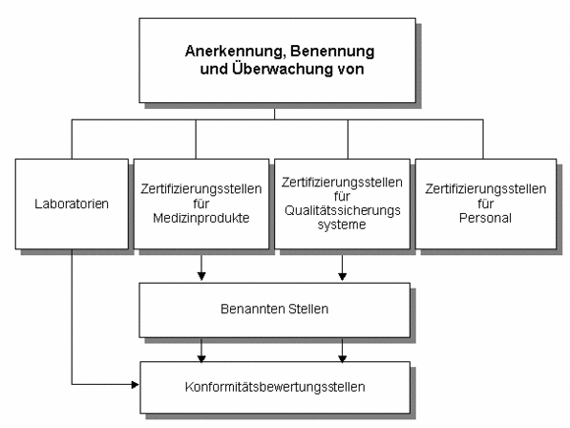
- Laboratorien
- Zertifizierungsstellen für Medizinprodukte
- Zertifizierungsstellen für Qualitätssicherungssysteme
- Benannte Stellen
- Konformitätsbewertungsstellen
Voraussetzung für die Anerkennung und Benennung ist die Erfüllung der Anforderungen des MPG in Verbindung mit den zutreffenden EG-Richtlinien und Normen sowie der zutreffenden Regeln für die Anerkennung und Benennung.
Bis Ende 2009 war die ZLG auch zuständig für die Akkreditierung in den oben genannten Bereichen. Aufgrund des § 1 Abs. 1 Akkreditierungsstellengesetz (AkkStelleG) ist die Zuständigkeit für alle Akkreditierungen auf die Deutsche Akkreditierungsstelle GmbH (DAkkS) übergegangen, jedoch führt die ZLG gemäß § 2 Abs. 3 Akkreditierungsstellengesetz in Verbindung mit § 4 AkkStelleG-Beleihungsverordnung Begutachtungen und Überwachungen im Bereich Medizinprodukte im Auftrag der DAkkS durch.
Durch Änderung des Abkommens über die ZLG wurde diese zur zentralen Koordinierungsstelle für die Medizinprodukteüberwachung bestimmt. Bei der ZLG eingerichtete Fachexpertengruppen arbeiten an der Weiterentwicklung des Qualitätssicherungssystems dieser Überwachung.
Die ZLG ist außerdem nationale Kontaktstelle für die zuständigen Behörden anderer Staaten und für die EU-Kommission.
Von der ZLG gebildete Expertengremien (Sektorkomitees und Horizontale Arbeitskomitees) erarbeiten Vorschriften über die Anforderungen, die bei Prüfung und Zertifizierung zu beachten sind.
Weiterhin ist die ZLG für die Benennung und Überwachung von Konformitätsbewertungsstellen im Rahmen der Abkommen der EG mit dritten Staaten (MRAs) zuständig.
Die ZLG ist Geschäftsstelle für den Erfahrungsaustausch der anerkannten und benannten Stellen.
Sie nimmt teil am Erfahrungsaustausch auf der Ebene der Europäischen Union und an Konsultationen im Rahmen der Abkommen der EG mit dritten Staaten (Abkommenstexte) und arbeitet an vertrauensbildenden Maßnahmen und in Arbeitsgruppen der Gemischten Ausschüsse mit.

