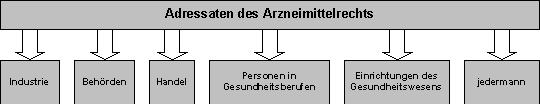
Gesetzgebungszuständigkeiten im Arzneimittelbereich
Allgemeines
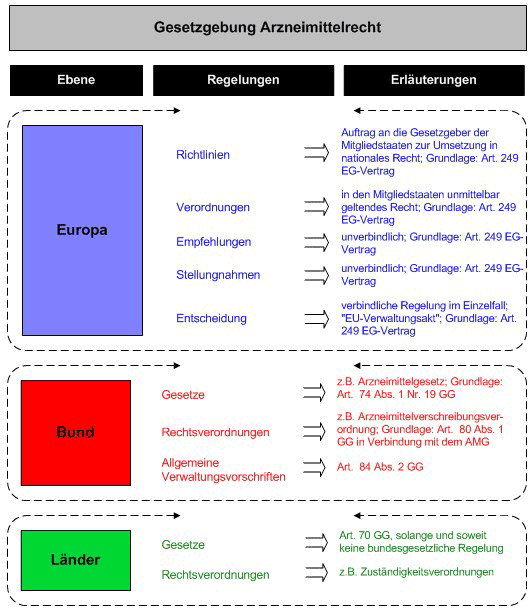
Da Rechtsetzung grundsätzlich auf allen Ebenen, d. h. auf europäischer Ebene, durch den Bund und durch die Länder erfolgen kann, ist eine Kompetenzabgrenzung erforderlich, die klar festlegt, auf welcher Ebene welche (arzneimittelrechtlichen) Regelungen getroffen werden dürfen (Normsetzungskompetenz). In der Tat werden auf allen genannten Ebenen arzneimittelrechtliche Vorschriften erlassen, die in ihrem Zusammenwirken das in Deutschland maßgebliche Arzneimittelrecht ausmachen. Die Rollen der einzelnen Rechtsetzungsebenen soll im folgenden kurz skizziert werden.
Europa
Die Europäische Gemeinschaft verfolgt unter anderem folgende politischen Ziele mit Auswirkungen auf den Arzneimittelbereich (Art. 3 EGV)
- gemeinsame Handelspolitik;
- Binnenmarkt, der durch die Beseitigung der Hindernisse für den freien Waren-, Personen-, Dienstleistungs- und Kapitalverkehr zwischen den Mitgliedstaaten gekennzeichnet ist;
- Angleichung der innerstaatlichen Rechtsvorschriften, soweit dies für das Funktionieren des Gemeinsamen Marktes erforderlich ist;
- Beitrag zur Erreichung eines hohen Gesundheitsschutzniveaus;
- Beitrag zur Verbesserung des Verbraucherschutzes
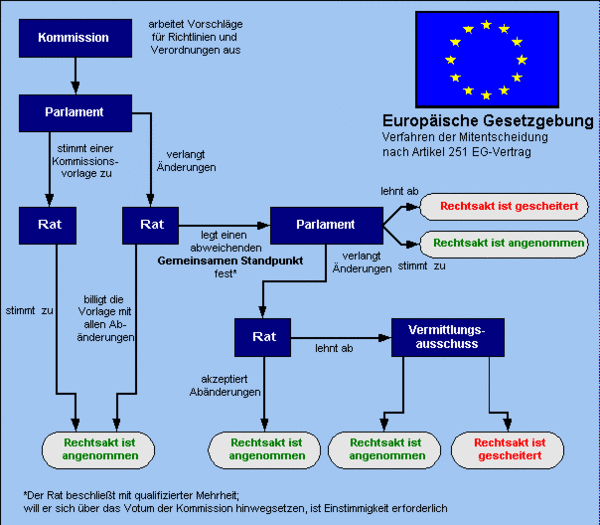
Das Europäische Parlament und der Rat gemeinsam, der Rat und die Kommission sind in diesem Zusammenhang befugt, Verordnungen, Richtlinien und Entscheidungen zu erlassen, Empfehlungen auszusprechen oder Stellungnahmen abzugeben (Art. 249 EGV).
Richtlinien sind für jeden Mitgliedstaat, an den sie gerichtet werden, hinsichtlich des zu erreichenden Ziels verbindlich, überlässt jedoch den innerstaatlichen Stellen die Wahl der Form und der Mittel. Verordnungen haben allgemeine Geltung, sind in allen ihren Teilen verbindlich und gelten unmittelbar in jedem Mitgliedstaat (Art. 249 EGV).
Das europäische Rechtssetzungsverfahren folgt dabei folgendem Ablauf:
Bund
Gesetze
Gemäß Art. 74 Abs. 1 Nr. 19 GG ist der dort genannte Rechtsbereich "Verkehr mit Arzneien, Heil- und Betäubungsmitteln und Giften" Gegenstand der konkurrierenden Gesetzgebung. Danach liegt das Recht der Gesetzgebung hier bei den Ländern, solange und soweit der Bund von seiner Gesetzgebungszuständigkeit nicht durch Gesetz Gebrauch gemacht hat (Art. 72 Abs. 1 GG). Der Bund darf hier allerdings nur gesetzgeberisch tätig werden, wenn und soweit dies für die Herstellung gleichwertiger Lebensverhältnisse oder die Wahrung der Rechts- und Wirtschaftseinheit im gesamtstaatlichen Interesse erforderlich ist (Art. 72 Abs. 2 GG). Dies wird für den Bereich des Arzneimittelrechts bejaht.
Zentrale bundesgesetzliche Rechtsvorschrift zur Regelung des Arzneimittelrechts, mit der der Bund im Rahmen der konkurrierenden Gesetzgebung von seiner Gesetzgebungskompetenz Gebrauch gemacht hat, ist das Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz - AMG). Dieses trifft zusammen mit den auf seiner Grundlage erlassenen Rechtsverordnungen (s. u.) umfassende Regelungen zum Arzneimittelbereich, nämlich u. a. über Herstellung, Zulassung, Registrierung von Arzneimitteln, klinische Prüfung, Vertrieb, Abgabe und Sicherung der Kontrolle der Qualität von Arzneimitteln, Tierarzneimittel, Arzneimittelrisiken, Überwachung, Einfuhr und Ausfuhr, Informationsbeauftragter, Pharmaberater, Haftung sowie Straf- und Bußgeldvorschriften. Weitere wichtige bundesgesetzliche Regelungen sind das Betäubungsmittelgesetz , das Transfusionsgesetz, das Apothekengesetz, die Apothekenbetriebsordnung, die Verordnung über tierärzltiche Hausapotheken sowie das Heilmittelwerbegesetz. Tierimpfstoffe sind vom Geltungsbereich des Arzneimittelgesetzes ausgenommen und werden im Tierseuchenrecht geregelt (Tierseuchengesetz; Tierimpfstoffverordnung).
Mit dem AMG werden durch europäisches Recht harmonisierte Anforderungen an den Verkehr mit Human- und Tierarzneimitteln umgesetzt (z. B. die kodifizierten Richtlinien 2001/82/EG und 2001/83/EG).
Rechtsverordnungen
Gem. Art. 80 Abs. 1 GG in Verbindung mit den einzelnen konkreten Ermächtigungen des Arzneimittelgesetzes können einzelne Bundesministerien ferner Rechtsverordnungen erlassen. Diese Rechtssetzung durch die Exekutive dient der Konkretisierung einzelner gesetzlicher Bestimmungen, indem sie die Detailregelungen den zuständigen Fachministerium und nicht dem Parlament überlässt, oder der Angleichung an Gemeinschaftsrecht (§ 83 AMG). Der Verordnungsgeber hat von dieser Rechtssetzungskompetenz unter anderem durch die folgenden Rechtsverordnungen Gebrauch gemacht:
| Rechtsverordnung | Grundlage |
| Verordnung zur Festlegung von Anforderungen an den Antrag auf Zulassung, Verlängerung der Zulassung und Registrierung von Arzneimitteln (AMZulRegAV) | § 35 AMG |
| Verordnung über die Standardzulassung von Arzneimitteln (StandZV) | § 36 AMG |
| Verordnung über die Standardregistrierung von Arzneimitteln (StandRegV) | § 39 AMG |
| Verordnung über apothekenpflichtige und freiverkäufliche Arzneimittel (AMVerkRV) | §§ 44-46 AMG |
| Verordnung über die Verschreibungspflicht von Arzneimitteln (AMVV) | § 48 AMG |
| Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV) | § 54 AMG |
| Arzneimittelhandelsverordnung (AM-HandelsV) | § 54 AMG |
Allgemeine Verwaltungsvorschriften
Gem. Art. 84 Abs. 2 GG in Verbindung mit § 82 AMG hat der Bund ferner mit Zustimmung des Bundesrates eine Allgemeine Verwaltungsvorschrift zur Durchführung des Arzneimittelgesetzes (AMGVwV) vom 29. März 2006 erlassen. Er kommt hierdurch seiner Gesamtverantwortung hinsichtlich der ordnungsgemäßen Anwendung bundesgesetzlicher Vorgaben durch die Länder nach.
Länder
Die umfassenden bundesrechtlichen Regelungen entfalten eine zeitliche und inhaltliche Sperrwirkung für den Erlass inhaltlicher arzneimittelrechtlicher Regelungen durch die Länder; diese sind hiervon weitgehend ausgeschlossen. Die im Arzneimittelbereich bestehenden landesrechtlichen Vorschriften erstrecken sich daher in erster Linie auf Regelungen zum Verwaltungs- und Behördenaufbau (Zuständigkeitsverordungen; Verwaltungsverfahrensgesetze), da die Länder die Bundesgesetze grundsätzlich als eigene Angelegenheit ausführen (Art. 83 GG) und in diesem Zusammenhang die Einrichtung der Behörden und das Verwaltungsverfahren selbst regeln (Art. 84 Abs. 1 GG). Die einheitliche Interpretation der bundesgesetzlichen arzneimittelrechtlichen Vorschriften wird durch ein länderübergreifendes Qualitätssicherungssystem gewährleistet.
Zurück zu: Rechtliches