Qualitätssicherungssystem der Arzneimittelüberwachung
Inhalt der Seite
Aufbau
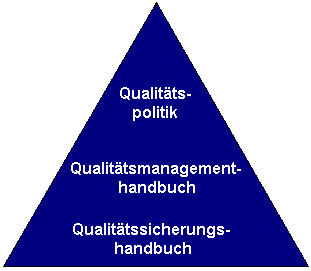
Das QS-System der Länder für den Bereich der Arzneimittelüberwachung und -untersuchung gliedert sich in drei Teile:
Qualitätspolitik
Die Qualitätspolitik beschreibt die Zielsetzung des Qualitätssystems für die Bereiche der Human- und Tierarzneimittelüberwachung sowie der Untersuchung von Arzneimitteln.
Qualitätsmanagement
Das Qualitätsmanagement-Handbuch beschreibt übergreifende Vorgaben auf folgenden, nach 17 Qualitätsleitlinien (QLL) gegliederten Gebieten:
QLL 1 - Verantwortung der obersten Leitung
QLL 2 - Verwaltungstechnische Vorkehrungen
QLL 3 - Organisation und Management
QLL 4 - Personal
QLL 5 - Dokumentation
QLL 6 - Kontrolle von Änderungen
QLL 7 - Inspektionsverfahren
QLL 8 - Erforderliche Ausstattung
QLL 9 - Qualitätssicherungs-Handbücher
QLL 10 - Vertrauensbildende Maßnahmen und Transparenz
QLL 11 - Internes Qualitätsaudit und regelmäßige Überprüfung (Management Review)
QLL 12 - Maßnahmen der Verwaltung bei Fehlern und Mängeln
QLL 13 - Umgang mit Fehlern, Bearbeitung von Beschwerden
QLL 14 - Vergabe von Aufgaben (einschließlich Einsatz von externen Sachverständigen)
QLL 15 - Erlaubniserteilung
QLL 16 - Zusammenarbeit
QLL 17 - Untersuchung von Proben
Qualitätssicherung
Das Qualitätssicherungshandbuch besteht aus 17 Kapiteln entsprechend der 17 Leitlinien.
Entstehung länderübergreifender Qualitätssicherungs-Dokumente
Das Prozedere zur Vorgehensweise ist in der VAW 051103 "Bearbeitung, Autorisierung und Verwaltung länderübergreifender QS-Dokumente" festgelegt:
Qualitätsdokumente werden von den Expertenfachgruppen der Länder unter dem Projektmanagement der ZLG erstellt bzw. überarbeitet. Die Überarbeitung beinhaltet dabei die anlassbezogene Änderung sowie die turnusmäßige Revision von Dokumenten.
Die fertiggestellten Dokumente werden inhaltlich und auf Übereinstimmung der äußeren Form mit der VAW 051101 [interner Link] geprüft und gezeichnet.
Die Länderreferentengremien für den Humanarzneimittelbereich, Tierarzneimittelbereich und den Tierimpfstoffbereich beschließen über Verfahrensanweisungen, Aide Mémoires und Formulardokumente. Die ZLG verteilt diese dann an die zuständigen obersten Landesbehörden, zur Genehmigung.
Die jeweils zuständigen Überwachungsbehörden setzen die Qualitätsdokumente zur Anwendung in Kraft.
Die QS-Dokumente können auch in ein bestehendes QS-System eines Landes oder einer Organisationseinheit integriert und dort genehmigt und in Kraft gesetzt werden.
Alle beschlossenen QS-Dokumente werden im Bereich "Qualitätssystem" [interner Link] der ZLG veröffentlicht und je nach Beschlussfassung entweder nur für Behörden oder auch für die Öffentlichkeit zugänglich gemacht.
Verantwortung und Kontrolle
Bei der Ausführung von Bundesgesetzen trägt jedes Land für seinen Zuständigkeitsbereich die Verantwortung selbst, wie z. B. die Überwachung gemäß § 64 AMG. Hierbei dienen nationale und europäische Regelungen und Interpretationshilfen als definierter Stand der Wissenschaft und Technik.
Deutschland und die übrigen Mitgliedstaaten der EU müssen aufgrund der Globalisierung zunehmend eine gleichartige und gleichwertige Vorgehensweise in Fragen der Arzneimittelüberwachung sicherstellen und nachweisen. In diesem System liegt dabei in jedem Land die Verantwortung für das Qualitätsmanagement grundsätzlich bei der jeweiligen Leitung einer Verwaltungsebene. Länderübergreifende Harmonisierung liegt in der Verantwortung der Gremien der unterschiedlichen Fachressorts für Human- und Tierarzneimittel.
Verantwortung und Kontrolle in jedem einzelnen Land
Jedes Land trägt für sich die Verantwortung für das Qualitätsmanagement auf den unterschiedlichen Verwaltungsebenen.
Dies beinhaltet u. a.:
- Genehmigung/In-Kraft-Setzen von Dokumenten in den einzelnen Behörden
- Schulung des Qualitätssystems (i. d. R. durch die QS-Beauftragten)
- Entwicklung von ergänzenden Zusatz-Dokumenten innerhalb der Rahmenvorgaben, soweit erforderlich
- Festlegung von Verfahren zur Umsetzung von Qualitätszielen
- Entgegennahme des Management Reviews für den jeweiligen Bereich,
- d. h. die unabhängige Bewertung des Qualitätsmanagementsystems für die Leitung der jeweiligen Verwaltungsebene. Sie erfolgt in festgelegten Abständen, mit dem Ziel, die Angemessenheit, Eignung und Wirksamkeit der Maßnahmen sicherzustellen.
- Durchführung von Selbstinspektionen und Audits
- Prüfung der Umsetzung und Ermittlung des Änderungsbedarfs innerhalb des Qualitätssystems.
Länderübergreifende Verantwortung und Kontrolle
Die Länder-Arbeitsgruppen für den Human- und Tierarzneimittelbereich, sowie den Tierimpfstoffbereich haben durch Beschlüsse die Wahrnehmung der länderübergreifenden Verantwortung für das Qualitätssystem weiter präzisiert:
| Bereich | Verantwortliche(s) Einrichtung/ Gremium | Verantwortungsbereiche |
| Qualitätspolitik | GMK AOLG, LAV | Schaffung der Voraussetzungen zur Einrichtung des QMS/QSS |
| Qualitätsmanagement | Arbeitsgruppen AG AATB, AG TAM, AGTT | Auf der Basis der Empfehlungen der
|
| Qualitätssicherung | Ministerien der Länder
|
|
| Akkreditierung | DAkkS |
|
| Koordinierung | ZLG |
|
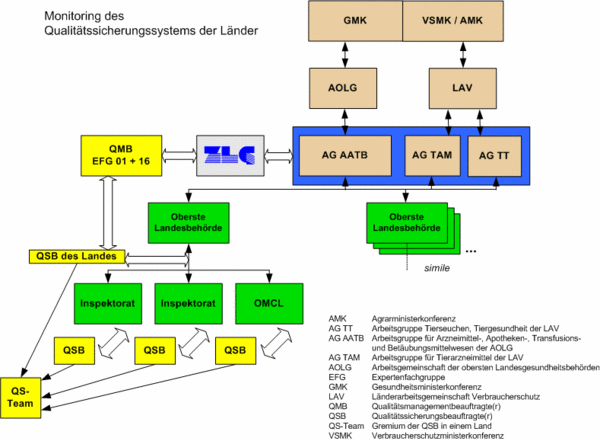
Hiernach liegt die Verantwortung für das Qualitätsmanagement des Gesamtsystems und somit die Hauptverantwortung bei den länderübergreifend tätigen Arbeitsgruppen auf Fachebene für den Human- (AG AATB) und Tierarzneimittelbereich (AG TAM) und den Tierimpfstoffbereich (AGTT). Die Verantwortung der drei Arbeitsgruppen beinhaltet dabei im Wesentlichen die Verabschiedung von Rahmenvorgaben, den Beschluss von Qualitätsdokumenten und die Prüfung von Umsetzungen sowie Entscheidungen über Änderungen. Die Tätigkeit der Fachgremien wird in QM-/QS-Fragen flankiert durch Aussagen zur Qualitätspolitik auf der politischen Ebene der Gremien der Abteilungsleiter in den obersten Landesbehörden (AOLG, LAV) wie auch der Minister/innen und Senator/innen (GMK).
Die übergeordneten Gremien AG AATB, AG TAM und AGTT kommen ihrer Aufgabe, über Dokumente zu entscheiden, die Umsetzung zu überprüfen und Änderungsbedarf zu ermitteln, durch ein Netz von Qualitätssicherungsbeauftragten der Länder nach. Jedes Bundesland stellt einen Vertreter in der Expertenfachgruppe 01 "Qualitätssicherung - Arzneimittelüberwachung und -untersuchung". Diese stellt in ihrer Gesamtheit den Qualitätsmanagement-Beauftragten für das Gesamtsystem. Die EFG 16 "Tierimpfstoffe" übernimmt diese Aufgabe für den Tierimpfstoffbereich.
Die Qualitätssicherungsbeauftragten der Länder erhalten durch die Qualitätssicherungsbeauftragten der einzelnen Behörden gebündelte Informationen über ihr Land im Rahmen der Arbeit in den länderspezifischen QS-Teams (gemäß VAW 041106).
Die Expertenfachgruppe 01 berichtet in ihrer Qualitätsmanagement-Funktion für das Gesamtsystem über die länderübergreifende Umsetzung des Qualitätsmanagement- und -sicherungssystems. Dies beinhaltet u. a. grundsätzliche Informationen zur Gesamt-Compliance im Ergebnis der gemäß VAW 111102 durchgeführten Qualitätsaudits bei den Überwachungsbehörden der Länder. Sie bringt diese Informationen sowie Informationen zum Änderungsbedarf über die ZLG in das jeweils verantwortliche Gremium (AG AATB, AG TAM, AGTT) ein. In den Gremien wiederum werden Entscheidungen bezüglich des Gesamtsystems getroffen.
Die Verantwortungen der einzelnen Gremien sind bzw. werden in Geschäftsordnungen beschrieben. Die Kommunikation findet nach einem Kreislaufsystem statt, welches entscheidend für das Funktionieren des Gesamtsystems ist:
Seitens des Bundes ist eine Novellierung der Allgemeine Verwaltungsvorschrift zur Durchführung des Arzneimittelgesetzes (AMGVwV) zur Unterstützung der rechtlichen Bindungswirkung des länderübergreifenden Qualitätssystems beabsichtigt.
Vergleich mit EU-Systemen
Die EU hat ihrerseits zur Sicherstellung der einheitlichen Anwendung gemeinschaftlicher Vorgaben ein Joint Audit Programme für den Bereich der Arzneimittelüberwachung entwickelt. Hierbei wird die Umsetzung von Vorgaben der Gemeinschaft (u. a. EU-Recht, Compilation of Community Procedures) im Rahmen eines Systemaudits wie auch durch Überprüfung der Inspektionsdurchführung geprüft.
Das hierbei vorgesehene Konzept für die Mitgliedstaaten ähnelt in seiner Struktur dem oben beschriebenen deutschen System zur Sicherstellung der einheitlichen Anwendung des Qualitätssystems bei Bewahrung föderaler Strukturen.
Die Durchführung der Audits sowie die Beratung zu Umsetzungs- und Compliance-Fragen erfolgt in kleineren Gruppen. Vorschläge für weitere Maßnahmen werden auf der Ebene der Fachgremien bei der europäischen Zulassungsbehörde EMA erarbeitet und im Falle ungelöster schwerwiegender Probleme an die EU-Kommission zur Entscheidung über weitere Maßnahmen weitergeleitet.
Historie
Zur Aufarbeitung der HIV-/HCV-Infektionsübertragungen durch mangelhaft hergestellte und getestete Blutprodukte in den 90er Jahren hat sich eine unter Vorsitz des Bundesministeriums für Gesundheit eigens eingesetzte Bund-Länder-Arbeitsgruppe zu Blut/Blutprodukten mit der Frage der Optimierung der Überwachung befasst. In ihrem Bericht „Sicherheit bei Blut und Blutprodukten“ kam die Arbeitsgruppe zu folgender Auffassung:
"Entsprechend den internationalen Vorgaben zur gegenseitigen Anerkennung der Inspektionen und zur Gewährleistung der Qualität der Inspektionen soll in den Ländern ein Qualitätssicherungssystem für die Überwachung aufgebaut werden, das von einer länderübergreifenden Stelle zertifiziert wird."
Als eine wichtige Maßnahme hat der Länderausschuss für den Humanarzneimittelbereich 1996 beschlossen, die Qualitätssicherung in der Arzneimittelüberwachung und –untersuchung einzuführen. Parallel dazu hat die Gesundheitsministerkonferenz (GMK) 1996/1997 die Einrichtung einer zentralen Koordinierungsstelle für den Arzneimittelbereich bei der ZLG beschlossen. Der Abteilung "Arzneimittel" in der ZLG haben die Länder die Koordinierung zur Erarbeitung eines Qualitätssystems für die Überwachung und Untersuchung übertragen.
Im Jahr 1998 haben dann die Länder die "Richtlinie für die Überwachung der Herstellung und des Verkehrs mit Blutzubereitungen" verabschiedet.
Zwischenzeitlich hat die Europäische Kommission mehrere Vorgaben für das Inspektionswesen zur Harmonisierung in Europa mit den "Compilation of Communitiy Procedures on Administrative Collaboration and Harmonisation of Inspections" zusammengestellt. Heute liegt eine aktualisierte Version aus dem Jahr 2001 vor. Mit Einführung der "Richtlinie für die Überwachung des Verkehrs mit Arzneimitteln" im Jahr 1998 haben die Länder die Compilation of Community Procedures in Deutschland umgesetzt.
Angesichts der Bewertung der Überwachungssysteme durch den Drittstaatenpartner Kanada im Zusammenhang mit dem Mutual Recognition Agreement (MRA) auf Äquivalenz haben die Länder in den Jahren 1999/2000 mit themenbezogenen Expertenfachgruppen, die sich aus Inspektoren der Länder zusammen setzen, die Erarbeitung des Qualitätssystems weiter vorangetrieben. Die ZLG hat diese Aktivitäten koordiniert und unterstützt.
Das Fachgremium der Länder für den Humanarzneimittelbereich hat 1999 Kernaussagen zur Qualitätspolitik, das Qualitätsmanagementhandbuch und die ersten Dokumente des Qualitätssicherungshandbuches (Verfahrensanweisungen, Inspektionshilfen - Aides mémoire) für den Bereich der Überwachung von Humanarzneimittel-Herstellern beschlossen. Die für den Tierarzneimittelbereich zuständige Arbeitsgruppe der Länder (AG TAM – Arbeitsgruppe für Tierarzneimittel der Arbeitsgemeinschaft der obersten Landesveterinärbehörden - LAV) fasste 1999 einen entsprechenden Beschluss. Die Konferenz der für das Gesundheitswesen zuständigen Ministerinnen und Minister, Senatorinnen und Senatoren der Länder hat im April 2000 die Kernaussagen zur Qualitätspolitik beschlossen und damit den höchstmöglichen Grad der Verbindlichkeit und Einheitlichkeit auf Länderebene erreicht.
Eine erste umfassende Überarbeitung des überwiegenden Teils der Dokumente des Qualitätssicherungshandbuches erfolgte im Jahr 2000/2001.
In weiteren Schritten wurde die zusätzliche Erstellung von Verfahrensanweisungen für den Bereich der Anwendung von Tierarzneimitteln und die Einführung des Qualitätssystems für den Bereich der Tierimpfstoffe umgesetzt.
Alle gültigen Dokumente können auf der Website der ZLG im Bereich "Qualitätssystem" abgerufen werden [interner Link].
Mit der Einführung des Qualitätssystems und der dort dokumentierten, übergreifenden Verantwortung für den Bereich der Arzneimittelüberwachung und –untersuchung haben die Länder das Konzept der Harmonisierung im föderalen System verwirklicht. Health Canada hat dies bei dem Vergleich des deutschen Systems mit dem kanadischen Arzneimittelüberwachungssystem nach einer Überprüfung von seinerzeit 37 Überwachungsbehörden und 11 Arzneimitteluntersuchungsstellen bestätigt.